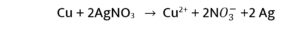नमस्कार दोस्तों आज के इस पोस्ट में कक्षा 12 के कमेंट्री विषय का बहुत ही महत्वपूर्ण क्वेश्चन बताया है मुझे उम्मीद है कि आप इस को बहुत पसंद करेंगे मैं इस क्षेत्र में 13 सालों से काम कर रहा हूं आपको बेहतर से बेहतर अनुभव देने का प्रयास करूंगा कक्षा बारहवीं बोर्ड परीक्षा में पूछे जाने वाले रसायन विज्ञान के अति महत्वपूर्ण प्रश्न Free Top 50 Question की सूची यहां पर दी गई है। आप इसे अंतिम तक पढ़े और कमेंट करके जरूर बताएं।
अतिलघु उत्तरीय प्रश्न
रेडॉक्स विभव
प्रश्न – रेडॉक्स विभव किसे कहते हैं?
उत्तर – जब सेल में ऑक्सीकरण तथा अपचयन अभिक्रिया होती है तो धातु और विलयन के मध्य स्थापित विभवान्तर को रेडॉक्स विभव कहते हैं, जैसे

.
जहाँ E रेडॉक्स विभव है और n ऑक्सीकारक ( Ox ) द्वारा ग्रहण किये गये इलेक्ट्रॉनों की संख्या है जिन्हें ऑक्सीकारक ग्रहण करके अपने संगत अपचायक में बदल देता हैं।
प्रश्न – 2. किसी सेल के विद्युत वाहक बल से क्या तात्पर्य है?
उत्तर – किसी सेल के इलेक्ट्रोडों के इलेक्ट्रोड विभवों में वह अन्तर, जब सेल से परिपथ में कोई विद्युत धारा नहीं बहती है, सेल का विद्युत वाहक बल कहलाता हैं।
प्रश्न- 3. कॉपर सल्फेट के विलयन में लोहें की कील डालने पर क्या होगा?
उत्तर – कॉपर सल्फेट के विलयन में लोहे की कील के ऊपर कॉपर की परत चढ़ जायेगी, क्योंकि कॉपर की सक्रियता लोहे से कम होती हैं।
प्रश्न – 4. जिंक तथा ताँबे में से एक अम्लों से हाइड्रोजन गैस विस्थापित नहीं करता है। क्यों?
उत्तर – वैद्युत रासायनिक श्रेणी में जिंक हाइड़्रोजन से ऊपर तथा ताँबा हाइड्रोजन से नीचे स्थित है जिसके कारण जिंक हाइड्रोजन से अधिक अपचायक है और ताँबा कम अपचायक है। इसीलिए जिंक अम्लों से हाइड्रोजन को विस्थापित करता है परन्तु, ताँबा नहीं करता हैं।
प्रश्न – 5. विद्युत रासायनिक श्रेणी में ऐलुमिनियम हाइड्रोजन से ऊपर है किन्तु यह वायु और जल में स्थायी है। क्यों?
उत्तर – यद्यपि विद्युत रासायनिक श्रेणी में ऐलुमिनियम हाइड्रोजन से ऊपर है किन्तु यह वायु और जल में स्थायी है क्योंकि यह गर्म जल या जलवायु के साथ उच्च ताप पर क्रिया करता है और साधारण ताप पर जल के साथ इसकी क्रिया मन्द होती हैं।
प्रश्न – 6. लवण विलयनों से धातुओं के विस्थापन की व्यख्या विद्युत रासायनिक श्रेणी के आधार पर कीजिए।
उत्तर – कम इलेक्ट्रोड विभव वाली धातु अधिक इलेक्ट्रोड विभव वाली धातु को उसके लवण के विलयन में से प्रतिस्थापित कर देती है। विद्युत रासायनिक श्रेणी में नीचे की और चलने पर इलेक्ट्रोड विभव कम होता जाता है। चूँकि विद्युत रासानिक श्रेणी में Zn तथा Fe धातुएँ Cu से ऊपर स्थित हैं अतः इनका इलेक्ट्रोड विभव से कम होता है और ये Cu को उसके लवण विलयन CuSO4 में से विस्थापित कर देती हैं, जबकि Pt और Ag का स्थान विद्युत रासायनिक श्रेणी में Cu से नीचे होता है जिसके कारण इनका इलेक्ट्रोड विभव Cu से अधिक होता है। इसी कारण से ये Cu को इसके लवण विलयन में से विस्थापित नहीं कर पाती हैं।
प्रश्न – 7. चालकत्व को परिभाषित कीजिए तथा चालकत्व एवं प्रतिरोध में सम्बन्ध बताइए।
उत्तर – किसी विद्युत अपघट्य के एक घन सेमी विलयन का चालकत्व उसका विशिष्ट चालकत्व कहलाता है। इसे G से प्रदर्शित करते हैं।
चालकत्व ( G ) = 1/प्रतिरोध (R)
प्रश्न – 8. आयनिक विलयनों की चालकता का मापन किसी प्रकार किया जाता हैं?
उत्तर – किसी विलयन के प्रतिरोध के व्युत्क्रम के उस विलयन की चालकता कहते हैं। किसी आयनिक विलयन की चालकता का मापन उसके प्रतिरोध की माप द्वारा किया जाता हैं।
प्रश्न- 9. सिल्वर नाइट्रेट के घोल में कॉपर की छड़ डालने पर घोल नीला क्यों हो जाता हैं?
उत्तर – वैद्युत रासायनिक श्रेणी का प्रत्येक तत्व अपने से नीचे स्थित तत्वों को उसके विलयन से विस्थापित कर सकता है। श्रेणी में Cu का स्थान Ag से ऊपर है, अतः यह AgNO3 से निम्नलिखित क्रिया देगा –
इस प्रकार विलयन में क्यूप्रिक आयन ( Cu2+ ) विद्यमान होने से विलयन का रंग नीला हो जायेगा।
प्रश्न -10. कॉपर सल्फेट के विलयन में जस्ते की बनी छड़ डालने पर उसका नीला रंग धीरे – धीरे गायब हो जाता है। क्यों?
उत्तर – कॉपर सल्फेट के विलयन में जस्ते की बनी छड़ डालने पर सका नीला रंग धीरे – धीरे गायब हो जाता है क्योंकि विद्युत रासायनिक श्रेणी में Zn धातु Cu से ऊपर स्थित है जिसके कारण वह Cu को उसके लवण विलयन अर्थात CuSO4 में से विस्थापित कर देती है।
प्रश्न- 11. विशिष्ट चालकता से क्या तात्पर्य है? इसका मात्रक क्या हैं?
उत्तर – किसी चालक के विशिष्ट प्रतिरोध के व्युत्क्रम को उस चालक की विशिष्ट चालकता ( या केवल चालकता ) कहते हैं। इसे ग्रीक अक्षर K ( कप्पा,kappa ) से निरूपित किया जाता हैं।
K= 1/p
विशिष्ट चालकता के मात्रक ओम -1 सेमी -1 या S सेमी -1 हैं।
यह भी पढ़ें Chemistry 400 Question Free PDF
प्रश्न – 12. कोलराउश का नियम क्या है?
या
कोलराउश के नियम को समझाइए। इस नियम के अनुप्रयोग उदाहरण सहित लिखिए ।
उत्तर – इस नियम के अनुसार,‘‘ किसी विद्युत अपघट्य की अनन्त अनुता पर चालकता इसके धनायनों तथा ऋणायनों की मोलर चालकताओं के योग के बराबर होती है, यदि प्रत्येक चालकता पद को विद्युत अपघट्य सूत्र में उपस्थित संगत आयनों की संख्या से गुणा किया जाये।’’
कोलराउश के नियम के अनुप्रयोग
(1) अनन्त तनुता पर दुर्बल विद्युत अपघटय की मोलर चालकता ज्ञात करना ।
(2) दुर्बल वैद्युत अपघटयों के वियोजन की मात्रा की गणना करना।
फैराडे का विद्युत अपघटन का प्रथम नियम
प्रश्न – 13. फैराडे का विद्युत अपघटन का प्रथम नियम लिखिए।
उत्तर – इस नियम के अनुसार, ‘‘ विद्युत अपघटन की प्रक्रिया में किसी इलेक्ट्रोड विशेष पर मुक्त ( अथवा एकत्रित) पदार्थ का द्रव्यमान विलयन में प्रवाहित की गई विद्युत की मात्रा ( कुल आवेश ) के समानुपाती होता है।’’
प्रश्न- 14. मोलर चालकता तता तुल्यांक चालकता में क्या सम्बन्ध है?
उत्तर – मोलर चालकता तथा तुल्यांक चालकता में निम्नलिखित सम्बन्ध है-
मोलर चालकता,
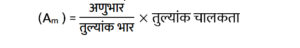
फैराडे का विद्युत अपघटन का द्वितीय नियम
प्रश्न – 15. फैराडे का विद्युत अपघटन का द्वितीय नियम लिखिए।
उत्तर – इस नियम के अनुसार, जब श्रेणी क्रम में जुड़े विभिन्न विद्युत अपघट्यों के विलयनों में समान मात्रा में विद्युत प्रवाहित की जाती है, तो इलेक्ट्रोडों पर मुक्त ( या एकत्रित ) पदार्थों के द्रव्यमान उनके तुल्यांक भारों के समानुपाती होते हैं।

विद्युत लेपन को उदाहरण
प्रश्न – 16. विद्युत लेपन को उदाहरण द्वारा संक्षेप में समझाए।
उत्तर – विद्युत अपघन द्वारा कम सक्रिय धातु की कलई अधिक सक्रिय धातु पर चढ़ाई जाती है। इस प्रक्रिया को विद्युत लेपन कहते है। धातुओं की होने वाली अवांछनीय संक्षारण क्रिया को विद्युत लेपन द्वारा रोका जाता है।
उदाहरणार्थ – लोहे की चादर पर जिंक या दिन का लेप किया जाता है। क्योंकि जिंक या टिन की सक्रियता लोहे से कम है।
लघु उत्तरीय
प्रश्न – 1. कोलराउश नियम द्वारा दुर्बल विद्युत अपघट्य के वियोजन कोटि की गणना किस प्रकार करते हैं?
उत्तर – किसी दुर्बल विद्युत अपघट्य की मोलर चालकता उसके वियोजन की मात्रा पर निर्भर करती है। ( किसी विद्युत – अपघट्य के एक ग्राम – अणु ( एक मोल) से साम्य में वियोजित या आयनित अणुओं की संख्या को उसकी वियोजन या आयनन की मात्रा कहते हैं)
वियोजन की मात्रा उच्च होने पर मोलर चालकता भी उच्च होती है। तनुता बढ़ाने पर मोलर चालकता में वृद्धि होती है तता अनन्त तनुता पर विद्युत – अपघट्य पूर्ण वियोजित हो जाते हैं, अर्थात् उनकी वियोजन की मात्रा एक हो जाती हैं।
मानक इलेक्ट्रोड विभव
प्रश्न – 2. मानक इलेक्ट्रोड विभव क्या है? इलेक्ट्रोड विभव (E) और मानक इलेक्ट्रोड विभव (E) में सम्बन्ध लिखिए।
या
नर्स्ट समीकरण पर टिप्पणी लिखिए ।
या
नर्स्ट समीकरण लिखिए तथा उसकी एक उपयोगिता लिखिए।
उत्तर – मानक इलेक्ट्रोड विभव – किसी धातु की छड़ को 25 पर एक मोलर धातु आयन सान्द्रता के विलयन में डुबने पर धातु और विलयन के मध्य जो विभवान्तर उत्पन्न होता है, उसे धातु का मानक इलेक्ट्रोड विभव ( E) कहते हैं।
इलेक्ट्रोड विभव ( E) और मानक इलेक्ट्रोड विभव ( E) में सम्बन्ध
माना एक इलेक्ट्रोड अभिक्रिया इस प्रकार है –

इसे नर्स्ट समीकरण भी कहते हैं।
जहाँ, E धातु का मानक इलेक्ट्रोड विभव ( वोल्ट में ), R गैस नियतांक ( R= 8.312 JK-1 mol), T परम ताप (केल्विन में ) , F फैराडे नियतांक ( F = 96,485 C mol -1 ),n इलेक्ट्रोड अभिक्रिया में भाग लेने वाले इलेक्ट्रोनों के मोलों की संख्या तथा [Mn+] विलयन में धातु आयनों की सक्रियता अथवा मोल प्रति लीटर में व्यक्त सान्द्रता है।
नर्स्ट समीकरण का उपयोग विभिन्न तापों तथा आयन सान्द्रताओं पर स्थित इलेक्ट्रोड के इलेक्ट्रोड विभवों की गणना करने के लिए किया जा सकता है।
प्रश्न – 3. प्रबल तथा दुर्बल विद्युत अपघट्यों को उदाहरण द्वारा समझाइए।
प्रबल विद्युत अपघट्य
उत्तर – प्रबल विद्युत अपघट्य – वे विद्युत – अपघट्य जो जलीय विलयन में या अन्य ध्रुवीय विलायकों के साथ बने विलयन में लगभग पूर्णतः आयनित हो जाते है, प्रबल विद्युत अपघट्य कहलाते हैं, जैसे – NaCl, KCl, HCl, NaOH, KOH आदि।
दुर्बल विद्युत अपघट्य
दुर्बल विद्युत अपघट्य – वे विद्युत – अपघट्य जिनका जलीय विलयन में या ध्रुवीय विलायकों के साथ बने विलयन में बहुत कम आयनन होता है, यहाँ तक कि अत्यधिक तनुता पर भी पूर्णतः आयनन नहीं होता, दुर्बल विद्युत अपघट्य कहलाते हैं, जैसे – CH3,COOH, NH4OH, H2CO3, H3BO3, HCN आदि।
प्रश्न – 4. इलेक्ट्रोड विभव किसे कहते हैं? इसका मान किन-किन कारकों पर निर्भर करता है?
उत्तर – जब किसी धातु (इलेक्ट्रोड) को उसी धातु के किसी लवण विलयन में रखा जाता है तो धातु तथा विलयन के सम्पर्क स्थल पर वैद्युत द्विक – स्तर उत्पन्न हो जाता है जिसके फलस्वरूप धातु तथा विलयन के मध्य विभवान्तर उत्पन्न हो जाता है जिसे इलेक्ट्रोड विभव कहते हैं। इसे Eसे प्रकट करते है और इसे वोल्ट में मापा जाता है। उदाहरणार्थ – जब कॉपर की छड़, कॉपर सल्फेट के विलयन में डुबोई जाती है तो कॉपर की छड़, विलयन के सापेक्ष ऋणावेशित हो जाता है जिससे कॉपर धातु और कॉपर आयनों के मध्य विभवान्तर उत्पन्न हो जाता है।
Cu (g) Cu2+ +
इस विभवान्तर को कॉपर इलेक्ट्रोड कका विभव कहते है।
इलेक्ट्रोड विभव निम्नलिखित कारकों पर निर्भर करता है-
- चालक की प्रकृति – जिस इलेक्ट्रोड की चालकता अधिक होगी वह उतना ही अधिक इलेक्ट्रोड विभव उत्पन्न करता है।
- धात्विक आयन की विलयन में सान्द्रता – सान्द्रता बढ़ाने पर इलेक्ट्रोड विभव का मान घटता है, क्योंकि सान्द्रता बढ़ाने पर आयनन घट जाता है, फलस्वरूप चालककता कम हो जाती है।
- तापक्रम – इलेक्ट्रोड विभव का मान ताप पर भी निर्भर करता है जो ताप बढ़ाने पर आयनन बढ़ जाने के कारण बढ़ता है।
प्रश्न – 5. वैद्युत रासायनिक श्रेणी किसे कहते है? इसके प्रमुख लक्षण तथा दो प्रमुख उपयोग लिखिए।
वैद्युत रासायनिक श्रेणी
उत्तर – वैद्युत रासायनिक श्रेणी – विभिन्न धातुओं तथा अधातुओं के मानक इलेक्ट्रोड विभवों ( अपचयन विभव) को बढ़ते हुए क्रम में रखने पर जो श्रेणी प्राप्त होती है, उसे वैद्युत रासायनक श्रेणी कहते है।
वैद्युत रासायनिक श्रेणी के लक्षण –
- श्रेणी में ऊपर से नीचे की ओर जाने पर तत्वों की अपचयन क्षमता घटती है, जबकि नीचे से ऊपर जाने पर अपचयन क्षमता बढ़ती है।
- हाइड्रोजन से ऊपर के सभी तत्व अम्लों से अभिक्रिया करके हीइड्रोजन गैस मुक्त करते हैं, जबकि नीचे वाले तत्व अम्लों से अभिक्रिया करके हाइड्रोजन गैस मुकत नहीं करते है।
- हाइड्रोजन से ऊपर के सभी तत्त्व जल या भाप के साथ क्रिया करके H2 गैस देते हैं।
- जिस तत्त्व का अपचयन विभव जितना अधिक होता है, वहि उतना ही प्रबल अपचायक होता है।
- जिस तत्त्व का अपचयन विभव जितना कम होता है, वह उतना ही प्रबल अपचायक होता है।
- श्रेणी का ऊपर वाला तत्त्व को उसके विलयन से विस्थापित कर देता है।
उपयोग – वैद्युत रासायनिक श्रेणी के दो उपयोग निम्नवत् हैं-
1. किसी सेल के मानक वैद्युत वाहक बल का निर्धारण करने में,
2. धातुओं की क्रियाशीलता की तुलना करने में।
विद्युत अपघट्य की तुल्यांकी चालकता
प्रश्न – किसी विद्युत अपघट्य की तुल्यांकी चालकता एवं मोलर चालकता को परिभाषित कीजिए। सान्द्रता परिवर्तन करने पर इन पर क्या प्रभाव होगा?
या
किसी विलयन की चालकता तनुता के साथ क्यों घटती हैं?
उत्तर – तुल्यांकी चालकता – एक सेमी दूरी एवं एक वर्ग अनुप्रस्थ परिच्छेद के क्षेत्रफल वाले दो समान्तर इलेक्ट्रोडो के बीच रके विलयन में यदि एक ग्राम तुल्यांक विद्युत अपघट्य घुला हो तो इस अवस्था में विलयन की चालक्ता उस विद्युत अपघट्य की तुल्यांकी चालकता कहलाती है।
मोलर चालकता – एक सेमी दूरी एवं एक वर्ग सेमी अनुप्रस्थ परिच्छेद के क्षेत्रफल वाले दो समान्तर इलेक्ट्रेडों के बीच रखे विलयन में यदि एक ग्राम मोल विद्युत अपघट्य घुला हो तो इस अवस्था में उसकी चालकता उस विद्युत अपघट्य की मोलर चालकता कहलाती है।
तुल्यांकी चालकता व मोलर चलकता पर सान्द्रता का प्रभाव –
विद्युत अपघट्यों के विलयनों की सान्द्रता घटाने पर ( तनुता बढ़ाने पर ) जिसकी तुल्यांकी चालकता व मोलर चालकता का मान बढ़ता है क्योंकि तनुता बढ़ाने पर विशिष्ट चालकत्व का मान घटता है। परन्तु एक ग्राम तुल्यांक या एक ग्राम अणु विद्युत अपघट्य रखने वाले विलयनों का आयतन बढ़ता हैं। एक ग्राम तुल्यांक या एक ग्राम मोल विद्युत अपघट्य वाले विलयनों का विशिष्ट बढ़ता जाता है, फलस्वरूप तुल्यांकी चालकता व मोलर चालकता के मान तनुता बढ़ाने पर बढ़ते है।
प्रश्न – 7. मानक हाइड्रोजन इलेक्ट्रोड का सचित्र वर्णन कीजिए तथा इसकी एक उपयोगिता भी लिखिए।
उत्तर – मानक हाइड्रोजन इलेक्ट्रोड – मानक हाइड्रोजन इलेक्ट्रोड में काँच की नली में बंद प्लैटिनम इलेक्ट्रोड होता है जिस पर सूक्ष्म विभाजित के 1M विलयन ( सामान्यतः 1M HCl ) में रखा जाता है तथा इसमें 1 वायुमण्डल दाब पर शुद्ध H2 गैस निरन्तर प्रवाहित की जाती है। प्लैटिनम पर उपस्थित सूक्ष्म विभाजन प्लैटिनम ब्लैक H2 को अवक्षेपित करके H2 तथा 1H+ आयनों में शीघ्र साम्य स्थापित करने में सहायता करता है। मानक हाइड्रोजन इलेक्ट्रोड कैथोड और ऐनोड दोनों के समान कार्य कर सकता है। जब यह ऐनोड की भाँति कार्य करता है, ततब ऑक्सीकरण होता है और कुछ हाइड्रोजन गैस H+ आयनों में परिवर्तित हो जाती है।